por Tayná Fiúza
No dia 22 de maio de 2020 a OMS atualizou a lista de candidatos vacinais no combate à Covid-19. Agora são dez os candidatos distribuídos entre as fases de estudo clínico 1 e 2 e 114 em estágio de avaliação pré-clínica. Atualmente, todas as principais categorias de vacina estão em estágio avançado de pesquisa: as vacinas de vírus inativado, de vetor viral não replicante, de proteína, de RNA e de DNA.
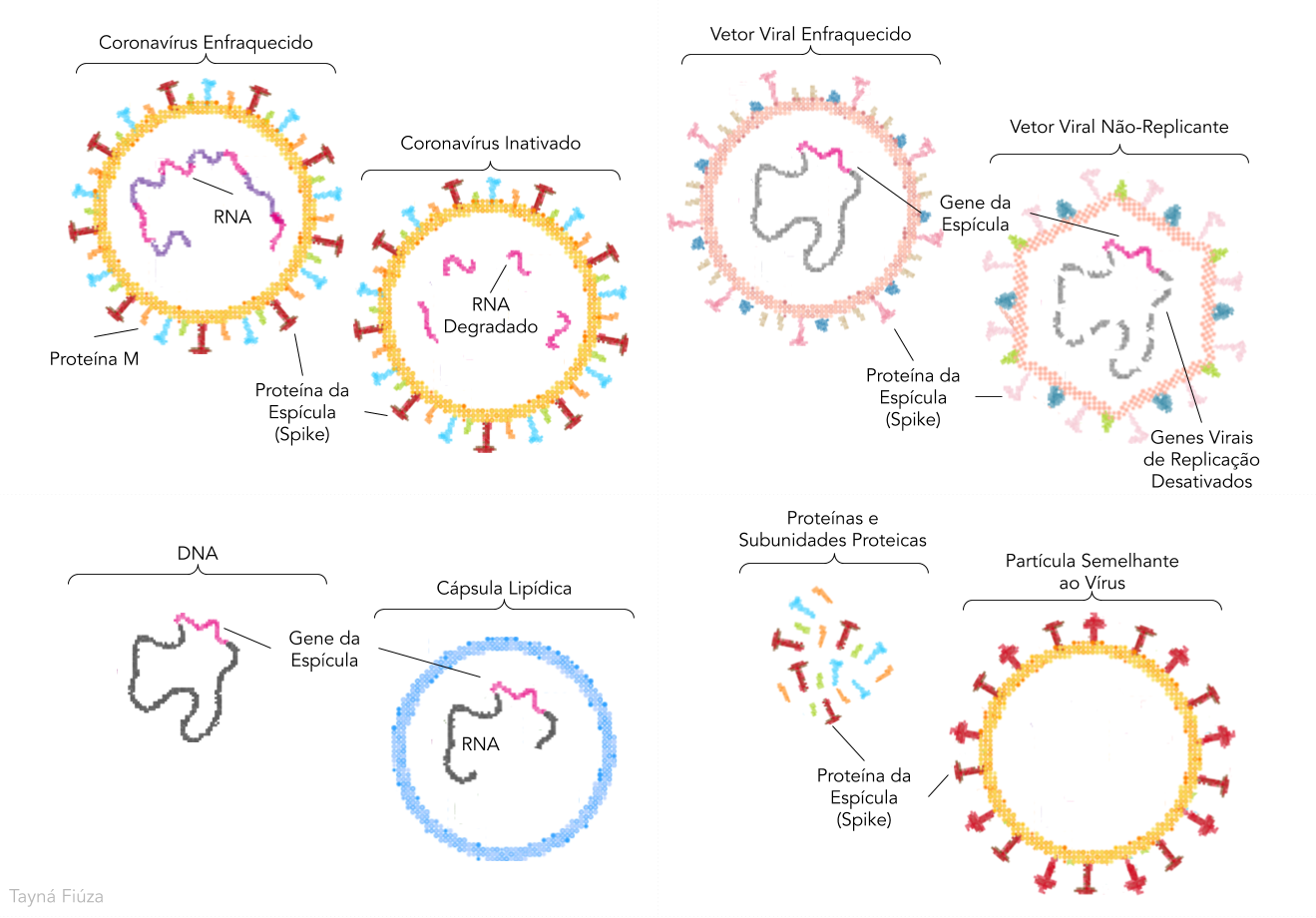
As vacinas de vírus contém o próprio patógeno enfraquecido (por passagem em diferentes células de seres vivos que não permitem o desenvolvimento da infecção) ou inativado (pelo uso de formaldeído ou calor). É o caso da vacina em fase 1 produzida pelo Instituto de Biologia Médica da Academia Chinesa de Ciências Médicas e das vacinas em fase 1/2 produzidas por três instituições chinesas, a Sinovac, o Instituto de Produtos Biológicos de Pequim e o Instituto de Produtos Biológicos de Wuhan, estas últimas duas em parceria com a Sinopharm, importante companhia farmacêutica chinesa. Muitas das vacinas disponíveis atualmente, como as de poliomielite e sarampo, são formuladas desta maneira, porém, há a necessidade de extensos testes de avaliação de segurança destes terapêuticos.
Já com as vacinas de vetor viral se utiliza um vírus já conhecido e estudado, como o do sarampo, que é modificado para produzir algumas das proteínas do vírus em questão, neste caso, do Sars-Cov-2. Ele pode ser veiculado em sua forma enfraquecida (como na vacina contra o Ebola) ou mesmo sem os genes que o permitem se multiplicar, como nas formulações em fase 2 propostas pela Universidade de Oxford/Astrazeneca/Instituto Sorológico da Índia e pelo Instituto de Biotecnologia de Pequim/CanSino Biological Inc.. Nesses casos, a dose inicial tem que ser suficiente para gerar uma resposta imune ou reforços vacinais se fazem necessários.
Vacinas de ácidos nucleicos utilizam moléculas como o RNA e o DNA contendo as instruções de produção de proteínas do vírus alvo de estudo e inserem essas moléculas em células humanas. Este método é o mais seguro e prático em comparação aos demais. Contudo, ainda não existem vacinas desta categoria no mercado. No relatório da OMS, uma vacina de DNA está sendo avaliada pela Inovio Pharmaceuticals (ainda em fase 1) e duas de RNA: uma por um consórcio entre BioNTech, Fosun Pharma e Pfizer e outra pela Moderna/Instituto Nacional de Alergias e Doenças Infecciosas dos EUA, ambas em fase 2.
As diferentes estratégias vacinais exploram as características de vigilância do sistema imune. As abordagens escolhidas se baseiam na presença de Células Apresentadoras de Antígenos, responsáveis por fagocitar - ingerir - células e moléculas presentes na corrente sanguínea a poderão apresentar aquelas com características de antígeno às células T. Sendo células T-auxiliares, estas poderão estimular células B a produzir anticorpos contra os antígenos identificados. No caso de células T-citotóxicas, estas poderão então causar a morte célular de outras células que contenham o antígeno identificado. Dada esta ativação de células T e B, outra característica do sistema imune explorada dentro da abordagem vacinal é a sua capacidade de memória, que poderá garantir proteção contra um determinado antígeno/patógeno por meses e até anos através da manutenção e proliferação de células T e B semelhantes às envolvidas no reconhecimento e controle do antígeno.
Há ainda as estratégias em que proteínas (ou fragmentos de proteínas, como subunidades) do patógeno são diretamente apresentados ao sistema imune. Esta é a proposta da Novavax em fase 1/2, em que uma glicoproteína de Sars-Cov-2 e uma nanopartícula adjuvante são empregados. Alguns outros grupos trabalham na construção de partículas semelhantes ao vírus, em que a superfície externa do vírus seria construída sem conter material genético em sua porção interior. A vantagem deste método é a capacidade de geração de uma resposta imune mais intensa, porém sua produção é mais laboriosa.
Os estudos são divididos em pré-clínicos, quando animais modelos de diferentes espécies de acordo com a condição estudada são empregados para avaliar a toxicidade e os efeitos fisiológicos do candidato a terapia; clínicos, em que um número crescente de indivíduos com características diversas (sexo, idade, etnia, histórico de saúde) são convidados a participar de modo a garantir a eficácia e segurança da(s) vacina(s).
Os estudos clínicos são subdivididos em clínicos de fase 1, em que indivíduos saudáveis (20-100) são divididos em grupos para receber diferentes doses ou formulações da terapia e a segurança é avaliada (assim como sua possível interação medicamentosa); clínicos de fase 2, em que um número maior de indivíduos (100-300), neste caso enfermos, é selecionado para obter mais dados da segurança e observar a eficácia das diferentes doses; clínicos de fase 3, em que diversos centros de pesquisa e saúde avaliam e comparam os efeitos da terapia proposta em relação a alternativas disponíveis em um número ainda maior de indivíduos (5000-1000); e clínicos de fase 4 ou farmacovigilância, em que o produto proposto está disponível no mercado e seus efeitos colaterais e fatores de risco são prontamente acompanhados pelos órgãos responsáveis. Ainda não há propostas de vacinas para Covid-19 nas fases 3 e 4.
Para produção da primeira vacina contra o Ebola, foram cinco anos de estudo até sua disponibilização, metade do tempo usual para o desenvolvimento de uma vacina. Frente a esse recorde, pesquisadores e agências de saúde e regulação seguem trabalhando juntos para disponibilizar uma vacina contra o Sars-Cov-2 em cerca de 18 meses, reconstruindo paradigmas de pesquisa, desenvolvimento clínico, escalonamento, produção industrial e processos regulatórios para mitigar os impactos humanitários negativos da pandemia.
Referências:
Draft landscape of COVID 19 candidate vaccines
https://www.who.int/who-documents-detail/draft-landscape-of-covid-19-candidate-vaccines
The race for coronavirus vaccines: a graphical guide
https://www.nature.com/articles/d41586-020-01221-y
The COVID-19 vaccine development landscape